La Journée d’Information Médicale (JIM) précédée de l’Assemblée Générale (AG) s’est tenue le samedi 16 mars 2019 à l’hôpital Tenon (Paris).

Agenda
- Présentation du centre de compétences Rendu-Osler de Tenon – Pr Jacques CADRANEL et Dr Antoine PARROT (Pneumologie et Centre de Référence Constitutif Maladies Pulmonaires Rares de l’Adulte – Hôpital TENON)
- La Maladie de Rendu-Osler par le prisme d’une consultation – Dr Antoine PARROT
- Focus sur la prise en charge des enfants – Pr Ralph EPAUD (Pneumologie Pédiatrique – CHI Créteil)
- La recherche médicale – Anne-Emmanuelle FARGETON (Centre National de Référence – Lyon)
- Les Malformations Artério-Veineuses Pulmonaires – Pr Marie-France CARETTE (Radiologie Interventionnelle Vasculaire – hôpital TENON)
Quoi de neuf pour les MAVPs (Echo de bulles – TDM low dose – Pourquoi une injection d’iode ou pas ?- du coils au plug et micro-Plug – Contrôle par bulles, TDM ou angio-IRM)
Réponses à vos questions relatives aux MAVP’s - L’association AMRO-HHT-France – Gilles COUDRETTE
- Echanges entre participants sous forme de 3 ateliers :
Deux ateliers d’échanges entre participants : expériences et témoignage.
Un atelier en amphi (avec expert Santé Info Droits) : RO et vie professionnelle (poste de travail aménagé, etc…). Accès aux prêts bancaires et aux assurances. - Réponses à vos questions (hors MAVP) – Pr Marie-France CARETTE, Dr Antoine PARROT
Vous trouverez ci-dessous les résumés des différentes séquences ainsi qu’un lien vers certaines présentations des exposants.
La Maladie de Rendu-Osler par le prisme d’une consultation– Dr Antoine PARROT
Introduction
Les objectifs d’une prise en charge sont d’éviter la survenue de complications, sources d’une importante altération de la qualité de vie. Au vu des complications potentielles de la MRO, le dépistage et la surveillance sont donc essentiels d’autant plus qu’il existe des traitements efficaces.
La première consultation sera axée essentiellement sur le diagnostic de la maladie, la deuxième sur une synthèse avec un rendu génétique et ensuite il s’agit des consultations de suivi.
Première consultation
Le premier temps est d’écouter et d’examiner les patients pour voir si le diagnostic est possible. Le deuxième temps est de leur expliquer la maladie :
a) La MRO est une maladie rare, génétique, autosomique, dominante :
• rare : elle touche environ 1/6000 naissances, soit 10.000 personnes en France,
• génétique : elle est transmise par les gènes,
• autosomique : elle touche indifféremment l’homme et la femme,
• dominante : un patient malade possède un gène malade et un gène non malade. Malheureusement le gène malade « domine » le gène non malade et permet l’expression de la maladie. Un parent atteint a donc un risque sur 2 de transmettre le gène malade. Plus rarement un patient peut néanmoins avoir deux parents sains : on parle alors de mutation spontanée dite de novo.
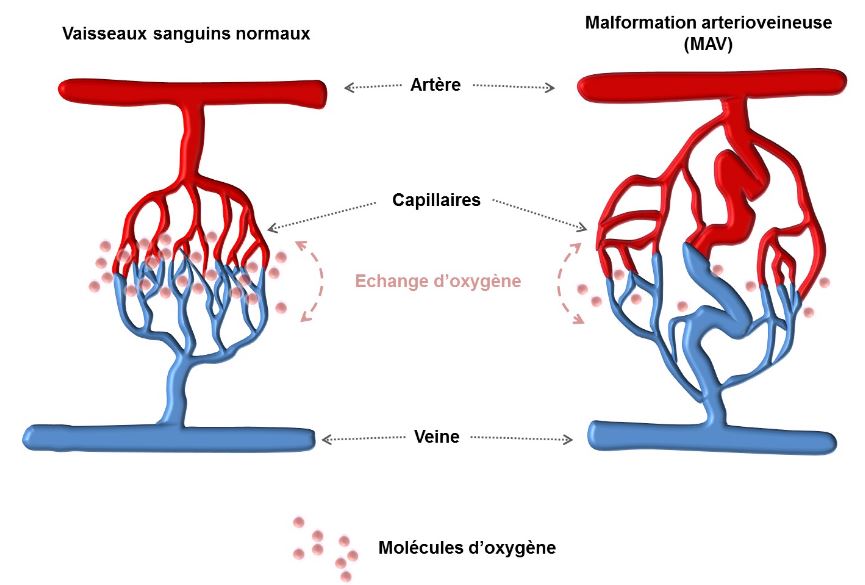
Le gène touché par la maladie intervient normalement dans l’architecture des vaisseaux. Si le gène est muté, l’architecture devient anormale avec la création d’une communication sous la forme d’un gros vaisseau entre une artère et une veine appelée fistule ou malformation artério-veineuse (MAV) – en principe entre une artère et une veine, il y a un petit réseau constitué par des capillaires qui dans le cadre de cette maladie se raréfie. Ces malformations architecturales sont appelées télangiectasies lorsqu’elles touchent des petits vaisseaux, par exemple au niveau de la peau.
Les gènes connus responsables de la MRO sont appelés : ACVRL1 (le plus fréquent : 60%), ENG (30%) et MADH4 (1%). Le dépistage génétique est possible dans plus de 90% des cas.
b) Expression de la maladie
Télangiectasies et Epistaxis
Les télangiectasies peuvent être présentes au niveau de la peau et des muqueuses du nez et de la bouche. En raison de cette anomalie les vaisseaux vont être fragilisés, d’où les saignements.
Les saignements de nez, appelés aussi épistaxis, sont présents chez 90% des personnes atteintes de la MRO. Ils apparaissent statistiquement à la puberté. Ils sont spontanés et irréguliers. Des saignements répétés peuvent entrainer de la fatigue, parfois des essoufflements et une carence en fer. Des perfusions de fer ainsi que des transfusions sanguines sont parfois nécessaires pour y remédier. Le suivi des épistaxis peut se faire via les grilles d’épistaxis (disponibles sur le site de l’AMRO).
Les télangiectasies au niveau de la peau concernent 80% des patients. Ce sont de petits points rouges que l’on retrouve sur les mains et le visage (lèvres, oreilles, langue). Elles apparaissent avec l’âge et leur nombre augmente au fil de la vie. Elles peuvent entrainer des saignements et poser un problème esthétique.
MAV
Les MAV peuvent être présentes au niveau des poumons (50%), du foie (30-70%), du cerveau (10%) et de la moelle épinière (1%).
MAV pulmonaires (MAVP)
Les symptômes liés aux MAVP sont les suivants, énumérés par ordre de fréquence :
• Aucun : la plupart du temps, les MAVP sont totalement asymptomatiques, d’où l’intérêt d’un dépistage systématique.
• Les complications neurologiques secondaires (6-20%) dues à la défaillance du rôle de filtre des poumons : 1) pour les caillots : accidents vasculaires cérébraux (embolies paradoxales), et 2) pour les microbes : abcès cérébraux (embolies septiques).
• Un essoufflement présent chez moins d’un quart des patients en rapport avec une hypoxémie (baisse de l’oxygène dans le sang), due à au fait que le sang ne passe plus dans les capillaires, là où se font les échanges avec l’air que l’on respire, mais dans la MAV qui n’a aucun contact avec l’air inspiré : en terme médical il s’agit d’un shunt droit gauche
• Le crachat de sang (appelé hémoptysie) est possible en cas de MAV volumineuses mais est rare depuis le dépistage systématique.
Le dépistage des MAVP se fait par scanner thoracique et/ou l’échographie du cœur avec épreuve de bulles. Le traitement des MAVP se fait par radiologie interventionnelle avec l’installation de coils et/ou de plugs pour boucher la MAV.
MAV hépatiques
Les symptômes liés aux MAVH sont les suivants, énumérés par ordre de fréquence :
• Aucun : La plupart du temps, les anomalies vasculaires hépatiques sont totalement asymptomatiques. Seuls 5 à 8 % des patients sont décrits avec des symptômes.
• Un essoufflement dû à un hyper-débit cardiaque. Il s’agit de la complication la plus fréquente (5 %) dont l’évolution progressive peut aboutir à une insuffisance cardiaque à haut débit.
• Un tableau d’ascite (épanchement de liquide dans l’abdomen) due à une hypertension portale (rare).
• Des douleurs abdominales aiguës dues à une nécrose biliaire.
Le dépistage et le bilan des MAVH se font par scanner hépatique, une échographie du foie et du cœur.
MAV neurologiques
Les MAV neurologiques sont peu fréquentes (10% pour le cerveau) chez les patients atteints de MRO. Celles-ci peuvent être cérébrales ou médullaires. Elles ne donnent souvent aucun signe clinique mais peuvent se manifester de manière brutale (hémorragie cérébrale ou médullaire, convulsions) ou progressive (compression médullaire lente).
Leur dépistage se fait via une IRM cérébrale ou médullaire. Le dépistage des MAV cérébrales n’est pas systématique. Pour les MAV médullaires, chez les femmes en âge de procréer, l’IRM est systématique pour éviter une péridurale traumatique lors de l’accouchement.
MAV/télangiectasies digestives
Les MAV digestives touchent près de 30% des patients et peuvent se traduire par des hémorragies digestives extériorisées (sang dans les selles, vomissement de sang), une anémie et/ou une carence en fer. Ces télangiectasies digestives peuvent concerner l’ensemble du tube digestif : estomac, intestins, colon. Elles se révèlent souvent à partir de l’âge de 30 ans. Leur dépistage n’est pas systématique.
Il est à noter :
– Qu’une personne peut être atteinte de la MRO sans avoir de symptômes initialement, mais à l’âge de 50 ans, plus de 90% des personnes atteintes sont symptomatiques (saigne du nez).
– Que suivant le gène atteint, l’expression clinique varie : une mutation du gène ACVRL1 sera susceptible d’entrainer plus de MAV hépatiques ; alors qu’une mutation des gènes ENG et MADH4 sera susceptible d’entrainer plus de MAV pulmonaires.
- Que la prise en charge de cette maladie fait intervenir différents spécialistes.
Le dernier temps de cette première consultation est d’établir une probabilité diagnostic et de réaliser le dépistage génétique si le patient le souhaite.
Le diagnostic clinique de la MRO repose sur l’association de 3 de ces 4 critères (critères de Curaçao) :
1. Epistaxis
2. Télangiectasies
3. Atteinte familiale
4. MAV
Le diagnostic clinique est :
• certain si au moins 3 critères coexistent ;
• suspecté ou possible si 2 critères sont constatés ;
• peu probable si 1 seul critère est présent.
Deuxième consultation
L’objectif est notamment le rendu des prélèvements génétiques. Si le patient présente le gène de la maladie un dépistage familial devra être proposé. Une synthèse de la maladie sera effectuée.
Consultations de suivi
Les objectifs du suivi sont de surveiller l’évolution de la maladie. Ce suivi se fait principalement au sein d’un centre labellisé pour la maladie de Rendu-Osler par le médecin référent en partenariat avec le médecin traitant.
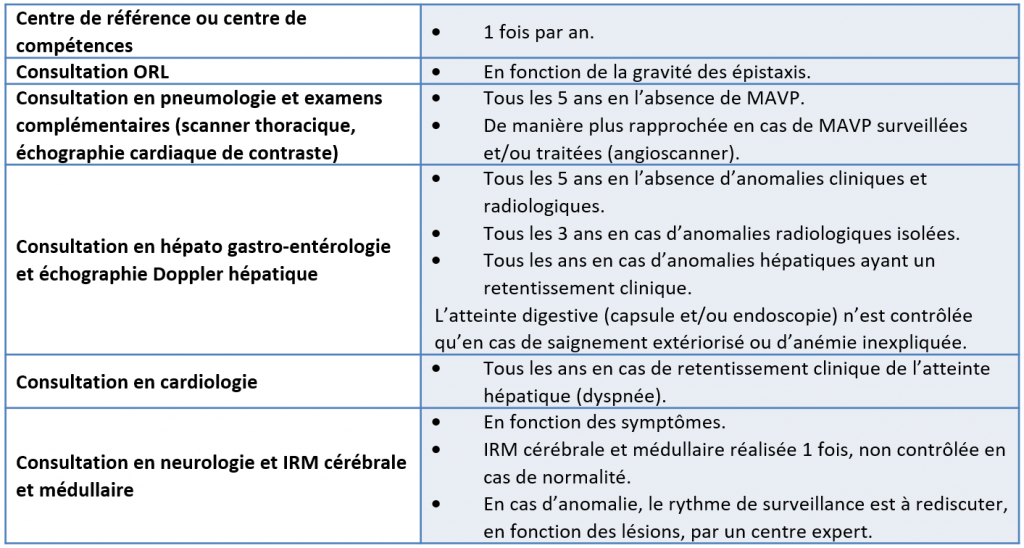
Le tableau ci-après présente un suivi type de l’évolution de la maladie proposé par le dernier protocole national de diagnostic et de soins (PNDS), lequel sera à réajuster au cas par cas.
Conclusion
Le dépistage de la MRO est primordial pour éviter les complications graves dues aux MAV. La prise en charge de la MRO se fait de manière pluridisciplinaire en raison des divers organes touchés. Il est donc important de se faire suivre dans un centre de compétence de la MRO pour une gestion globale de la maladie.
Focus sur la prise en charge des enfants – Pr Ralph EPAUD
Le Professeur Ralph Epaud, chef du service de pédiatrie et responsable du centre de référence des maladies respiratoires rares au CHI de Créteil, nous explique l’intérêt d’une prise en charge chez l’enfant atteint de la MRO. Son expérience en tant que pédiatre et un partenariat avec le Pr Marie-France Carette (hôpital Tenon) depuis une quinzaine d’années, ont amené une réflexion au sujet du dépistage de l’enfant.
Faut-t-il dépister les enfants ?
Les enfants sont asymptomatiques, ou n’ont que très peu de symptômes à l’âge pédiatrique. C’est donc la génétique qui va pouvoir signer l’atteinte de la maladie.
Très rarement, les enfants entrent dans la maladie avec des complications, qui peuvent être des complications pulmonaires, mais surtout aussi des accidents ischémiques cérébraux parfois sévères, ce qui a justifié le dépistage précoce de la maladie . Plusieurs études ont montré que les MAV pulmonaires et cérébrales peu-vent être détectées et traitées préventivement avant qu’elles ne s’expriment, d’où l’intérêt d’un dépistage qui va permettre de réduire le taux de complication.
Le Pr Epaud expose les recommandations pour le dépistage de l’enfant. Il préconise un dépistage moins agressif et il souligne l’importance d’avoir un médecin référent qui va pouvoir orienter l’enfant vers des spécialistes qui connaissent la maladie, pour un meilleur suivi médical.
Une bonne connaissance de la maladie dans un centre de référence de la maladie permet d’éviter les examens inutiles et répétés, d’amener l’enfant progressivement et dans les meilleures conditions vers un centre adulte. Cela permet également de lui apprendre à connaitre sa maladie, sachant qu’elle lui sera expliquée différemment en fonction de son âge.
Comment dépister les enfants ?
Le dépistage n’est pas fait de la même manière selon les hôpitaux et est basé sur un certain nombre de recommandations. A certains endroits, il peut même ne pas être proposé.
Le diagnostic clinique n’est pas simple car les critères de Curaçao ne sont pas déterminants, les enfants étant pour la plupart asymptomatiques. Comme chez l’adulte, c’est le test génétique qui va permettre de voir si l’enfant est porteur du gène. Si c’est le cas, différents examens peuvent être proposés selon les centres.
Les recommandations du PNDS sont les suivantes :
-Une radio pulmonaire est systématiquement proposée. Très souvent normal, elle sera complétée par un scanner thoracique en cas d’anomalie.
-Une échographie de contraste, examen peu agressif en termes d’irradiation mais bien souvent difficile à pratiquer sur un enfant peut-être proposé chez l’enfant de plus de 5 ans. Si l’échographie est anormale, elle sera suivie d’un scanner pulmonaire avec injection.
-Une IRM cérébrale et spinale est proposée égale-ment chez l’enfant, < 6 mois, > 6 ans. Si elle est normale, il est conseillé de refaire cet examen car les MAV peuvent apparaître par la suite. Si elle est anormale, il y aura discussion avec un avis spécialisé d’un neuropédiatre.

Le Pr Epaud met l’accent sur le fait de définir des protocoles de dépistages non invasifs chez l’enfant, en tenant compte de l’âge. Il nous expose la manière de procéder à Trousseau et à Créteil, où ils proposent une approche un peu différente des recommandations. Cela consiste dans un premier temps à informer les parents et les enfants, quand ils sont plus grands et en âge de comprendre, aussi bien sur les risques que sur l’aspect délicat de faire certains examens.
Il est important d’écouter les parents ainsi que les enfants, en vue d’un consentement.
Un consentement des deux parties est nécessaire car l’enfant peut refuser de faire un examen. Il rappelle que légalement, l’enfant, s’il est en âge de raisonner, est en droit de ne pas accepter un examen.
Le test génétique va déterminer si l’enfant est porteur, si c’est le cas, des examens sont proposés : un scanner thoracique sans injection et une IRM cérébrale et médullaire sans injection permettent de dépister les anomalies les plus importantes. En fonction des résultats, soit un suivi clinique est suffisant, soit une discussion s’impose entre les différents protagonistes sur la conduite à tenir.
Il est nécessaire de rappeler que la réalisation d’un examen n’est jamais acquis chez l’enfant.
Les études montrent qu’il y a une fréquence plus élevée de MAVP chez les patients porteurs du gène codant l’Endogline. Avec le recul on sait maintenant aussi que les MAV sont présentes dès la naissance et qu’elles sont plus petites donc plus difficiles à détecter pour l’ACVRL1 (ALK1).
Une dernière question se pose, faut-il emboliser les enfants ? Oui selon le Pr Epaud, sinon le dépistage perd de son intérêt. Les parents sont sollicités pour qu’il y ait un retour quand l’enfant a été embolisé, et il est important également qu’il y ait un suivi clinique en conséquence.
Le dépistage de l’enfant n’est en aucun cas obligatoire, mais il faut retenir qu’il permet de détecter les MAV présentes dès la naissance. Il permet d’avoir une surveillance, un suivi adapté et il peut éviter d’entrer dans la maladie avec des complications.
La recherche médicale – Anne-Emmanuelle FARGETON
L’objectif principal des études cliniques actuellement en cours consiste à évaluer de potentiel traitement permettant d’agir sur les vaisseaux afin de diminuer les saignements en particulier sur les épistaxis (saignements de nez). La cible principale revient à évaluer les médicaments connus pour leur action anti-angiogéniques. (c’est-à-dire qui régulent la croissance des vaisseaux sanguins).
Plusieurs gammes de médicaments peuvent être étudiés : bétabloquants, immunosuppresseurs, anticorps monoclonaux, inhibiteurs de tyrosine kinase.
L’exposé décrit plusieurs études initiées par les centres de recherche clinique du réseau Rendu-Osler en France.
1)Etudes basées sur l’utilisation de Bétabloquants
Deux études cliniques entrent dans cette catégorie. L’étude TEMPO menée à Lyon se concentrant sur l’effet du TIMOLOL en administration nasale a donné récemment ses résultats qui malheureusement s’avèrent négatifs. Le traitement par spray deux fois par jour pendant 28 jours n’a pas montré d’efficacité. L’essai EPERO, sur le PROPANOLOL administré par voie orale, mené par l’équipe de Bordeaux, débute la phase des inclusions de patients. Cette étude est cofinancée par l’AMRO dans le cadre de l’appel à projet 2017-2019.
2) Etudes basées sur l’utilisation d’immuno-suppresseurs
L’étude TACRO, menée par le centre de référence de Lyon, à laquelle l’AMRO contribue dans le cadre de l’appel à projet 2017-2019, évalue l’efficacité et la tolérance de la pommade de Tacrolimus en administration nasale sur la durée des épistaxis. Le traite-ment est considéré comme efficace si la réduction constatée de la durée des épistaxis est de 30 %. Il s’agit d’une étude randomisée en double aveugle. Celle-ci est en phase finale, toutes les inclusions ayant été faites et les traitements de patient étant terminés. Au jour de la JIM, la levée d’aveugle n’avait pas eu lieu. Des études préliminaires ont montré, d’une part, un effet positif du traitement tant pour les patients traités par placébo que pour ceux traités par la formule active, démontrant le bénéfice l’application de la pommade de type vaseline, et, d’autre part, une différence d’efficacité entre les deux populations. Aucun passage du principe actif dans le sang n’a été noté.
Pour confirmer l’impact de traitement, il faudra attendre les résultats définitifs que l’AMRO communiquera dès que possible. Une étude à plus grande échelle est envisagée.
3) Etudes basées sur l’utilisation des inhibiteurs d’anticorps monoclonaux
Le médicament entrant dans cette catégorie le plus connu dans le cadre des études sur la maladie de Rendu-Osler est le BEVACIZUMAB ou AVASTIN® dont l’action sur la maladie de Rendu-Osler a été constatée par plusieurs équipes internationales, y compris par le centre de référence à travers d’étude METAFORE. Deux études passées (dont l’étude ALEGORI et une étude aux Etats-Unis) visant à évaluer l’utilisation de ce produit sous la forme de spray nasal n’ont pas donné de résultats positifs. Une nouvelle étude, dénommée BABH, sur l’utilisation de l’AVASTIN par voie intra-veineuse, la première faite sous la forme d’une étude en double aveugle, contre placébo a été lancée. Elle se concentre sur des cas d’hémorragies sévères et concerne plusieurs centres en France (Lyon, Paris AP, Montpellier, Angers). Elle inclura 24 patients à terme (18 déjà inclus au moment de la JIM). Elle est financée par un programme hospitalier de recherche clinique à raison d’un budget de 24 000€ par patient.
4) Etudes basées sur l’utilisation des inhibiteurs de Tyrosine Kinase
Les inhibiteurs de tyrosine kinase inhibent plusieurs récepteurs dans les mécanismes de régularisation de l’angiogenèse. De nombreuses molécules répondent à définition. Le PAZOPANIB et le NINTEDANIB sont des candidats ayant fait l’objet de publications dans le cadre de la maladie de Rendu-Osler. Le second utilisé en oncologie et pour d’autres indications a un profil de tolérance acceptable et peut s’administrer par voie orale. Une étude qui bénéficie du soutien fort utile du laboratoire qui produit le médicament, a donc été proposée sous le nom d‘EPICURE et débutera en mars 2019. Elle se concentre de nouveau sur l’efficacité en termes de réduction des épistaxis. Le nombre de patients envisagé est de 60 issus de 10 centres de compétences. (Si vous êtes intéressé pour participer à cette étude faites vous connaitre auprès du centre en charge de votre suivi et commencez à noter la durée de vos épistaxis à l’aide des grilles disponibles sur le site de l’AMRO.
L’exposé de Mme Fargeton s’est clos sur la description de l’étude ELECTRO. Ce projet, soutenu par l’AMRO vise à l’élaboration et validation d’une échelle de mesure de la qualité de vie spécifique à la maladie de Rendu-Osler. Le travail préliminaire a consisté à établir une liste de 75 items qui doit maintenant être testé sur 400 patients afin de réduire le questionnaire de qualité de vie à 20-25 items pertinents. Le projet comprend 3 autres étapes et doit donc se terminer en 2022.
Les Malformations Artério-Veineuses Pulmonaires – Pr Marie-France CARETTE
Rappels anatomiques
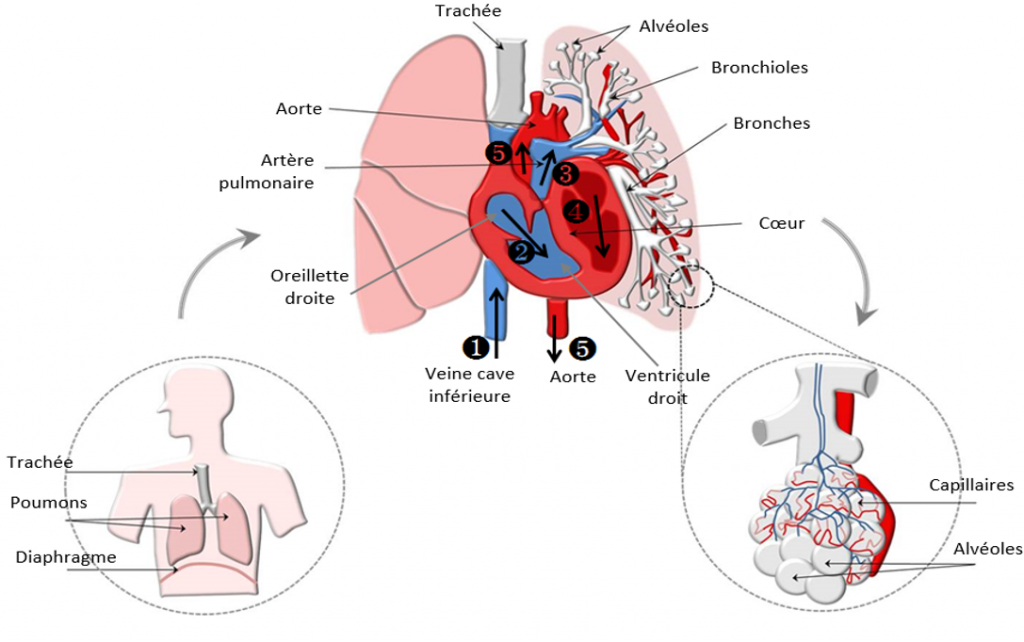
Les artères sont reliées aux veines par un réseau de petits vaisseaux : les capillaires. Les capillaires pulmonaires ont un rôle de filtre et d’oxygénation.
Le sang veineux, qui n’est pas oxygéné, arrive par les ❶ veines caves supérieure et inférieure dans ❷ le cœur droit (oreillette, puis ventricule). Il est ensuite éjecté dans ❸ les artères pulmonaires, pour arriver aux deux poumons. Dans les poumons, le sang qui circule alors dans un réseau de vaisseaux capillaires très fins est oxygéné au contact des alvéoles pulmonaires. Le sang alors oxygéné repart dans les veines pulmonaires vers ❹ le cœur gauche (oreillette puis ventricule) pour être éjecté dans ❺ l’aorte vers l’ensemble du corps et permettant d’oxygéner tous les organes.
Chez les personnes atteintes de la MRO, les artères / capillaires / veines peuvent être dilatés. Si les capillaires sont toujours présents, il s’agit de télangiectasies ; sinon il s’agit de malformation artério-veineuse pulmonaire (MAVP).
Conséquences des MAVPs
Shunt droit-gauche
Les MAVPs représentent un regroupement de capillaires sanguins en un seul canal. La capacité de captation de l’oxygène sera nulle au niveau de la MAV. Ceci, développé dans plusieurs endroits des poumons, peut alors entraîner un manque d’oxygène global dans le sang, appelé hypoxémie, responsable d’une mauvaise oxygénation des tissus ou hypoxie tissulaire. Celle-ci peut entraîner un essoufflement (dyspnée), ainsi qu’ une cyanose (ongles et lèvres bleus), voir un hippocratisme digital (bout des doigts en baguette de tambour) si cela dure depuis longtemps (ex: depuis l’enfance).
L’hypoxémie est aggravée en position assise ou debout car les MAVPs sont principalement présentes au niveau des lobes inférieurs des poumons.
Embolies paradoxales
Le réseau de capillaires pulmonaires joue un rôle de filtre, qui n’est plus assuré au niveau des MAVPs. Des complications neurologiques peuvent alors survenir : il s’agit d’accidents vasculaires cérébraux (embolies paradoxales de caillots, plus rarement, d’air) et/ou d’abcès cérébraux (embolies septiques).
Rupture de la MAVP
Les MAVPs peuvent se rompre dans la plèvre, responsables d’un hémothorax (sang dans la cavité pleurale), ou dans les bronches, responsables d’une hémoptysie (crachat de sang). Ceci est rare depuis le dépistage systématique suivi de traitement, mais c’est un risque en cas de grossesse, surtout lors de l’accouchement, si le dépistage n’a pas été fait. Cela reste un cas exceptionnel de décès en cas de rupture d’une MAVP volumineuse, chez une patiente accouchant avec une équipe qui n’est pas informée de la MRO.
Dépistage
Les conséquences du non-traitement des MAVPs peu-vent être graves : le taux de morbidité est de 26% et celui de mortalité de 11% dans les 6 ans suivant le diagnostic des MAVPs. Les études de balance bénéfices / risques sont en faveur du traitement des MAVPs.
Les MAVPs sont à rechercher chez tous les patients MRO car elles sont présentes dans 15 à 50% des cas, et en particulier si la personne présente une mutation des gènes ENG ou SMAD4. Les femmes sont principalement touchées (ratio H/F de 1/8).
Examens objectivant le shunt droit-gauche
L’échographie de contraste (EC) est l’examen principal pour détecter les MAVPs. Elle peut les détecter avec un taux de réussite de 96.5%. L’EC se fait avec une injection de microbulles. Si aucune MAVP n’est présente (ou que la MAVP est trop petite pour être traitée), ces microbulles sont seulement observées dans le cœur droit. Si les bulles sont observées tout de suite dans le cœur gauche, c’est qu’il y a un « trou » entre les atriums ; si on les observe après 3 cycles ou plus, c’est qu’il y a une/des MAVPs. Cette méthode peut exceptionnellement être responsable de migraines voire d’accidents ischémiques, transitoires ou non.
Visualisation directe des MAVPs
La radiographie du thorax est une méthode plus spécifique que l’EC mais beaucoup moins sensible. Elle nécessite une très faible irradiation, un peu inférieur à une semaine d’irradiation naturelle ou qu’un vol Paris-New-York. Si celle-ci est positive, elle évite l’EC.
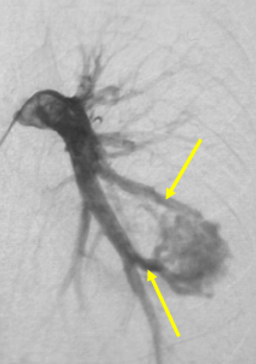
Etude de l’angio-architecture des MAVPs
Pour traiter les MAVPs, il faut savoir à quoi elles ressemblent. Ses éléments principaux sont : l’artère afférente (vaisseau entrant dans la MAV), la fistule ou malformation elle-même, et la veine efférente (vais-seau sortant de la MAV). Connaitre le nombre et la taille de ou des artères afférentes (AA) est l’élément le plus important, qui permet de catégoriser les MAVPs.
MAVP simple (80% des cas)
Celle-ci peut avoir une AA; ou plusieurs AA du même segment.
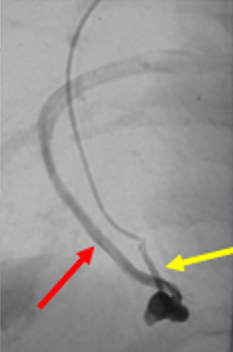
MAVP complexe (20% des cas)
Celle-ci comporte au moins deux AA de segments différents.
Traitement
Le traitement repose actuellement sur la radiologie interventionnelle (RI), évitant ainsi un geste chirurgical. Les anglosaxons parlent d’embolisation, les franco-phones préfèrent le terme de vaso-occlusion artérielle pulmonaire (VOAP) correspondant à l’occlusion de ou des AA, sans mouvement des dispositifs médicaux implantables (DMI) mis en place. Cette occlusion est réalisée le plus loin possible sur l’AA, juste en amont de la fistule, donc le plus proche possible du sac de la MAVP, sans introduire de matériel dans le sac. La taille des DMI employés est adapté à la taille de l’AA à ce niveau (on choisit une taille supérieure à la taille de l’AA, variable en fonction de chaque anatomie et du type de matériel employé, afin d’éviter le risque de migration de ce matériel).
De nombreux DMI sont, ou ont été, utilisés pour l’occlusion des AA :
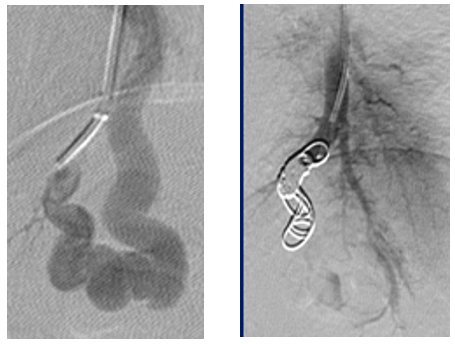
- ballons : avec de bons résultats ; ils ne sont plus utilisés en France actuellement.
- coils/ressorts : métalliques, mais actuellement non ferromagnétiques (passent dans une IRM), ils sont en platine, fibré ou recouvert d’un gel expansible. Ils sont, largués (+/- ancrés) ou détachés dans l’AA. L’occlusion parfaite n’est pas toujours facile et il y a un risque de migration si la taille du coil n’est pas évaluée correctement. Les facteurs d’échec im-médiat ou en rapport avec une reperméation sont liés à des AA de trop gros calibre (>7mm), une densité de coils mis en place trop faible, un place-ment trop proximal (loin de la fistule, laissant la possibilité de reprise en charge, sous le DMI, par une autre branche de l’artère pulmonaire ou par une artère bronchique) ou un traitement antithrombotique, qui empêche le caillot qui doit se former au sein de certains DMI pour que l’occlusion soit efficace.
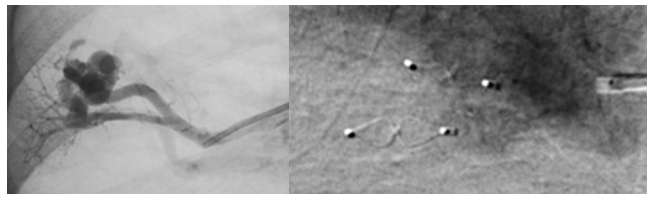
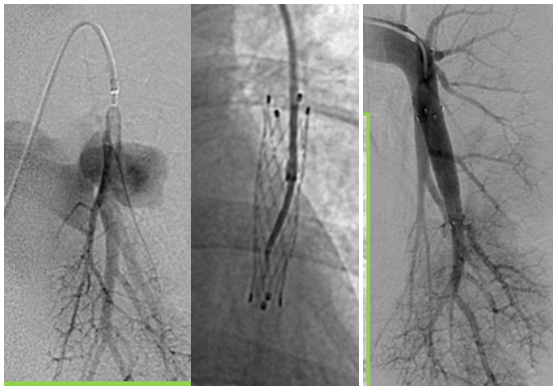
- plugs/bouchons : maillage de fils de Nitinol (alliage nickel et titane) auto expansible. Le plus utilisé actuellement est l’AVP IV, avec 2 ventres pour les artères de 3 à 6 mm. L’AVP II avec 3 ventres, convient aux grosses MAVPs de 7mm et plus. Des micro-plugs sont désormais disponibles pour un traitement efficace des petites MAVPs (1.5-5mm) : MVP Q3 et Q5. Leurs avantages sont : 1) de passer dans un microcathéter rendant accessible des MAVPs difficilement accessibles avec une sonde classique ; 2) ils sont couverts, permettant une occlusion immédiate sans attendre la formation d’un caillot dedans. Leur problème majeur actuel : le prix.
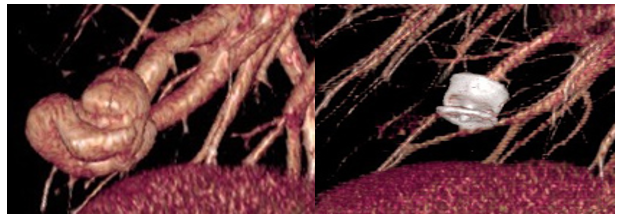
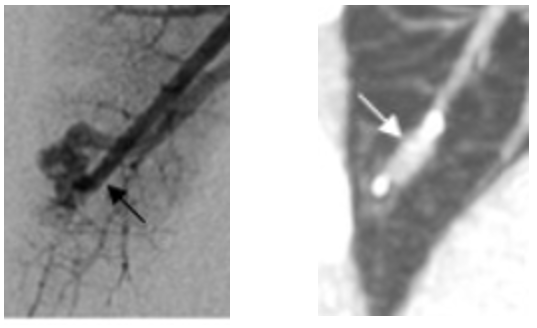
- stens couverts : dispositifs rarement utilisés, seule-ment en cas d’AA très courte avec une large ouverture sur la fistule, permettant d’occulter la fistule en laissant perméable le branche porteuse.
Des précautions sont à prendre avant une vaso-occlusion artérielle pulmonaire :
- Eviter l’admission d’air dans le sang : danger d’embo-lie gazeuse. Tout changement de guide et de cathéter est fait à Tenon sous immersion (d’autres techniques sont possibles).
- Eviter le caillotage du sang (le sérum utilisé est hépariné).
- Minimiser l’irradiation.
De cette procédure de RI sont attendus les résultats suivants :
- Amélioration de la saturation du sang en oxygène : moins d’essoufflements, meilleurs tolérance à l’effort.
- Disparition du shunt droit-gauche et des risques associés.
- Absence de la réduction de la capacité vitale.
- Absence de complication à long terme-
Il est possible que des shunts microscopiques persis-tent ; dans ce cas, il faut donc poursuivre la prévention des infections. La plongée sous-marine avec bouteille reste une activée interdite.
Contrôle
Suite à la vaso-occlusion, des contrôles sont nécessaires pour vérifier que la MAVP a bien été occluse : 6-12 mois après, puis 2-3 ans et 5 ans après. Les examens de contrôle sont variables suivant les cas.
Une échographie de contraste est utile si on a l’impression que, la MAVP, ou toutes les MAVPs ont été correctement traitées, pour confirmer l’absence de shunt droit-gauche résiduel. Si celle-ci est strictement négative, le traitement antibiotique préventif (pour les soins dentaires par exemple) peut être arrêté.
Une radiographie thoracique peut être effectuée si la MAV était grosse : elle peut montrer la régression de celle-ci.
Un scanner sans injection, basse dose, voire extra-ultra basse dose, est l’examen de choix pour le contrôle de MAVPs simples. Il affirme la bonne occlusion en cas de disparition de la fistule au-delà du DMI mis en place dans l’AA. On note en outre la réduction du diamètre de la veine efférente.
Un angio-scanner peut être utile dans le contrôle de VOAP des MAVPs complexes, à la recherche d’une circulation résiduelle et déterminer si une reprise est nécessaire.
Une angio-IRM est utile en cas d’artéfact en TDM (scanner), en rapport avec des DMI métalliques (mais non ferromagnétiques, contre-indication relative à l’IRM). Le passage du sang dans la MAVP y est plus facile à voir. En l’absence de passage de sang dans la MAVP (ce qui est le but de la VOAP), elle affirme la bonne occlusion.
Un échec de VOAP est affirmé sur le passage de sang au-delà du DMI et dans la MAVP (angio-TDM ou angio-IRM) ; il est fortement suspecté (TDM sans injection IV) sur la non régression de la taille de la MAVP et/ou sur une non régression ou régression insuffisante de la veine de drainage qui reste supérieure à 2.5 mm.
Attention, il n’est pas correct de dire que l’occlusion des grosses MAVPs entraîne la formation d’autres MAVPs. Il s’agit en fait d’une redistribution vasculaire : les « nouvelles » MAVPs étaient déjà présentes mais pas visibles. Le détournement du sang de l’ancienne MAVP aux petites MAVPs les rendent visibles après l’occlusion de cette première.
Conclusion
L’atteinte pulmonaire est fréquente chez les patients MRO. Elle peut avoir de graves conséquences si le dépistage et le traitement des MAVPs ne sont pas effectués, d’où l’intérêt d’un dépistage familial précoce pour les personnes à risque. Leur traitement est tout à fait accessible et résulte en un excellent pronostic fonctionnel et vital.
